MỘT CA BỆNH HIẾM TẠI KHOA NỘI HÔ HẤP: KHI “TÍCH PROTEIN TRONG PHẾ NANG” LẠI GIÚP TÌM HIỂU LẠI BỆNH PHỔI MÔ KẼ
Một ca bệnh hiếm tại Khoa Nội Hô hấp: Khi “tích protein trong phế nang” lại giúp tìm hiểu lại bệnh phổi mô kẽ
Tác giả: BSCKII Đặng Văn Ninh – Trưởng khoa Nội Hô hấp, Bệnh viện C Đà Nẵng
Trong thực hành lâm sàng, nhóm bệnh phổi mô kẽ (Interstitial Lung Diseases – ILD) luôn được xem là một trong những lĩnh vực phức tạp và nhiều thách thức nhất của chuyên ngành Hô hấp. Với sự phát triển nhanh chóng của kỹ thuật chẩn đoán hình ảnh và xét nghiệm miễn dịch, đặc biệt là HRCT ngực độ phân giải cao, các bác sĩ ngày càng phát hiện được nhiều thể bệnh hiếm, giúp mở rộng cách hiểu về sinh lý bệnh của các tổn thương phổi lan tỏa. Tuy nhiên, cùng với đó, không ít trường hợp gây tranh luận trong giới chuyên môn, nhất là khi hình ảnh tổn thương không điển hình, không có viêm hoặc xơ hóa mô kẽ rõ ràng. Ca bệnh dưới đây là một ví dụ tiêu biểu, không chỉ giúp củng cố kiến thức mà còn thay đổi cách nhìn về định nghĩa “bệnh phổi mô kẽ”.
Bệnh nhân nữ 68 tuổi, vào viện vì khó thở tăng dần trong nhiều tháng, ho khan, không sốt, không khạc đàm. Bệnh nhân không hút thuốc, không có tiền sử hen hoặc lao, chỉ có thói quen nuôi nhiều chim cảnh trong nhà. Kết quả HRCT phổi cho thấy hình ảnh kính mờ lan tỏa hai phổi xen kẽ dày vách liên tiểu thùy – hình ảnh “crazy paving: hình lát đá” điển hình. Các xét nghiệm cơ bản không phát hiện viêm, khí máu động mạch cho thấy PaO₂ giảm nhẹ. Nhận thấy tổn thương phổi lan tỏa nhưng không có dấu hiệu xơ, nhóm bác sĩ quyết định tiến hành nội soi phế quản và rửa phế quản (BAL). Dịch hút ra có màu trắng đục như sữa; xét nghiệm mô bệnh học nhuộm PAS cho kết quả dương tính, cho thấy trong phế nang có chứa nhiều chất lipoprotein vô định hình. Kết luận giải phẫu bệnh xác định: bệnh tích protein phế nang (Pulmonary Alveolar Proteinosis – PAP).
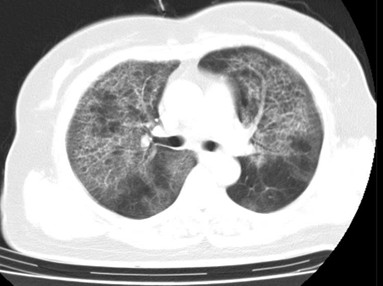
HRCT “crazy paving” – hình ảnh điển hình của bệnh tích protein phế nang
Điều khiến trường hợp này trở nên đặc biệt không chỉ nằm ở tính hiếm gặp của bệnh, mà còn ở chính phản ứng chuyên môn mà nó tạo ra. Trong buổi trình bệnh án tại hội trường lớn bệnh viện về chính ca bệnh này, một số bác sĩ đã đặt câu hỏi: “Nếu bệnh lý này chủ yếu nằm ở phế nang, vì sao lại được xếp vào nhóm bệnh phổi mô kẽ (ILD)?” Câu hỏi ấy thoạt nghe có vẻ đơn giản, nhưng thực tế đã chạm đến bản chất cốt lõi của cách phân loại bệnh phổi hiện đại. Từ góc nhìn truyền thống, “mô kẽ” thường được hiểu là tổ chức liên kết giữa các phế nang – nơi có thể bị viêm hoặc xơ hóa trong nhiều bệnh mạn tính như IPF hay NSIP. Nhưng trong thực tế, nhiều bệnh lý bắt đầu ở phế nang vẫn được xếp trong phổ ILD, bởi vì chúng gây ảnh hưởng lan tỏa đến trao đổi khí, làm thay đổi cấu trúc phế nang – mao mạch và dày vách kẽ thứ phát.
Để trả lời thấu đáo, cần nhìn vào cơ chế sinh lý bệnh của PAP. Theo hướng dẫn của Bộ Y tế Việt Nam năm 2023 và khuyến cáo của Hội Hô hấp châu Âu (ERS, 2024), PAP được xếp vào nhóm “bệnh phổi mô kẽ do tích tụ chất trong phế nang” (Infiltrative ILD). Cơ chế trung tâm của bệnh là rối loạn điều hòa đại thực bào phế nang, hậu quả của sự xuất hiện kháng thể kháng GM-CSF (Granulocyte–Macrophage Colony-Stimulating Factor). Ở người bình thường, GM-CSF là cytokine giúp đại thực bào phế nang trưởng thành và duy trì chức năng tiêu hủy surfactant – hỗn hợp lipid và protein được tế bào biểu mô phế nang type II tiết ra để giảm sức căng bề mặt. Khi kháng thể anti–GM-CSF xuất hiện, chúng trung hòa GM-CSF, khiến đại thực bào mất khả năng dọn dẹp surfactant cũ. Surfactant ứ đọng dần trong lòng phế nang, tạo thành chất lipoprotein PAS(+) và làm cản trở trao đổi khí.
Điều thú vị là mặc dù tổn thương khởi phát tại phế nang, nhưng hậu quả lại là giảm khuếch tán khí (↓DLCO), dày vách kẽ, và giảm oxy máu – các đặc điểm chức năng điển hình của bệnh phổi mô kẽ. Vì thế, PAP là ví dụ điển hình của nhóm bệnh “mô kẽ không viêm, không xơ” nhưng vẫn làm tổn hại cấu trúc phổi lan tỏa. Ngoài ra, cơ chế bệnh sinh của PAP cũng lý giải vì sao corticoid không có vai trò điều trị, thậm chí có thể làm nặng thêm bệnh do ức chế miễn dịch và tăng nguy cơ nhiễm trùng cơ hội (NTM, Nocardia, nấm). Phương pháp điều trị chuẩn hiện nay là rửa phổi toàn bộ (Whole Lung Lavage – WLL) nhằm loại bỏ lượng surfactant dư thừa, cải thiện trao đổi khí và phục hồi chức năng đại thực bào. Ở một số trung tâm trên thế giới, liệu pháp GM-CSF tái tổ hợp (Sargramostim hoặc Molgramostim) đang được triển khai như hướng điều trị sinh học đích.
Trường hợp bệnh nhân trên, sau khi được rửa phổi toàn bộ, tình trạng hô hấp cải thiện rõ rệt, PaO₂ và DLCO tăng lên, HRCT cho thấy giảm đáng kể tổn thương kính mờ. Bệnh nhân được xuất viện trong tình trạng ổn định và hẹn tái khám định kỳ để theo dõi tái phát. Đây không chỉ là một thành công về chẩn đoán mà còn là minh chứng cho hiệu quả của phối hợp đa chuyên khoa – giữa Hô hấp, Giải phẫu bệnh và Chẩn đoán hình ảnh – trong tiếp cận các bệnh phổi hiếm gặp.
Từ góc nhìn tổng quát, ca bệnh này giúp củng cố một bài học quan trọng: không phải mọi bệnh mô kẽ đều là viêm hoặc xơ hóa. Một số bệnh, như PAP, thuộc nhóm “mô kẽ chức năng” – tức là làm rối loạn trao đổi khí qua màng phế nang–mao mạch mà không gây viêm mô học điển hình. Việc hiểu rõ cơ chế GM-CSF – đại thực bào – surfactant không chỉ giúp chẩn đoán chính xác PAP mà còn mở ra cách nhìn mới cho toàn bộ phổ bệnh ILD, nơi cơ chế sinh học phân tử dần thay thế cách phân loại thuần giải phẫu học trước đây.
Ca bệnh PAP tại Khoa Nội Hô hấp – Bệnh viện C Đà Nẵng là minh chứng cho giá trị của tiếp cận đa chiều: lâm sàng, hình ảnh học, mô học và miễn dịch học. Đồng thời, nó cũng nhấn mạnh tầm quan trọng của việc cập nhật kiến thức quốc tế vào thực hành, giúp đội ngũ bác sĩ không chỉ điều trị đúng mà còn hiểu sâu về bản chất bệnh lý. Như lời kết từ buổi trình bệnh án: “Không phải mọi bệnh phổi mô kẽ đều là xơ hay viêm – có những bệnh phổi mô kẽ chỉ vì phế nang quên dọn dẹp chính mình.”

